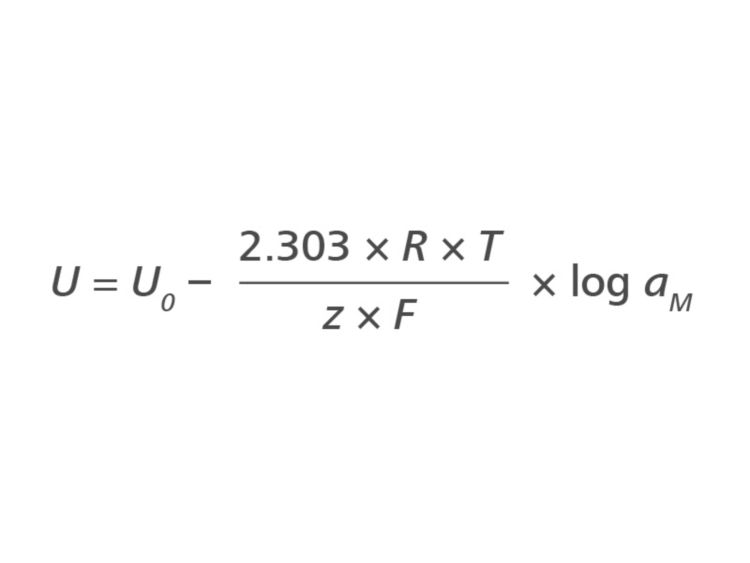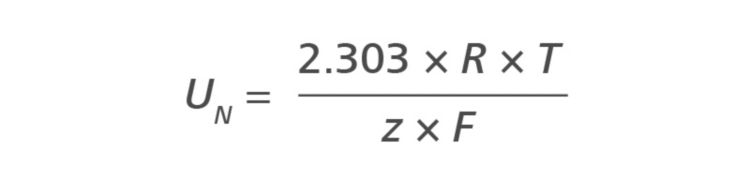温度のわずかな変化でも、pH測定には大きな影響があります。なぜなら、これら2つは密接に関連しているからです。温度はpH測定にさまざまな影響を与えます。この記事では、なぜそうなるのかを説明し、温度がpH測定に及ぼす異なる影響をどのように対処するかについて解説します。
以下のトピックをクリックすると直接移動できます:
– 「Long Life」参照電極を組み合わせた複合pH電極
– pH電極の校正
– 測定溶液の温度
なぜ温度がpH値に影響するのですか?
温度とpH値は、ネルンスト方程式によって関連付けられます。この方程式は、溶液中の測定イオンの活性aMと参照電極と測定電極間で測定される電位との間の理想的な関係を記述します。温度はネルンスト電位、つまりpH測定における傾きとも呼ばれるものに影響を与えます。
1℃の温度変化は0.2 mVの変化に相当します。相対的な観点で考えると、pHの差が0.01であれば、0.6 mVの変化に相当します。したがって、すべてのpH測定において温度を考慮する必要があります。さもなければ、キャリブレーションや測定温度が不明な場合、正確な結果が得られません。
スロープUNは異なる温度に対して異なります。T = 298.16 K = 25℃およびz = 1の場合、スロープUNは59.16 mVです。他の温度では、ネルンスト方程式において異なる値のスロープUNが使用されます。これを温度補償と呼びます。表1には、異なる温度に対するスロープの値がリストされています。
表1. 傾きと温度変化の関係
| 温度 T [℃] | 傾き UN [mV/pH unit] |
温度 T [℃] | 傾き UN [mV/pH unit] |
|---|---|---|---|
| 0 | 54.20 | 50 | 64.12 |
| 5 | 55.19 | 55 | 65.11 |
| 10 | 56.18 | 60 | 66.10 |
| 15 | 57.17 | 65 | 67.09 |
| 20 | 58.16 | 70 | 68.08 |
| 25 | 59.16 | 75 | 69.07 |
| 30 | 60.15 | 80 | 70.07 |
| 35 | 61.14 | 85 | 71.06 |
| 37 | 61.54 | 90 | 72.05 |
| 40 | 62.13 | 95 | 73.04 |
| 45 | 63.12 | 100 | 74.03 |
現代のpH計には、温度補償のための機能が含まれています。つまり、温度センサーがpH計に接続されると、傾きUNの温度依存性が自動的に考慮され、修正されます。温度を測定することは、正確なpH測定を確実にするだけでなく、すべての測定に対して温度の記録が必要とされるGLP/ISOガイドラインにも遵守します。
温度がpH測定に及ぼす影響とその対処方法
pH値は、おそらく分析化学における最も一般的に測定されるパラメーターです。製品の特性、化学および生化学反応、生理学的プロセスなどに影響を与えます。精密な測定結果を得るためには、しばしば一貫した周囲条件が必要です。
一部の場合、温度変化を避けることはできません。たとえば、ドアを開けるだけでも周囲温度が変化する可能性があります。エアコン環境で作業していても、発熱反応による温度上昇が発生する場合があります。温度変動の原因はさまざまであるため、このセクションでは準備のヒントを提供します。これらに従って、キャリブレーション/ pH測定を開始する前に、可能な温度に関連する効果を最小限に抑えるか、さらには排除してください。
適切なガラス膜の選択
さまざまなサンプルのpH測定をカバーするために、メトロームには、さまざまなタイプのガラス膜を有するpH電極があります。

ChatGPT
高温では、pH電極がより速く劣化し、膜の抵抗が増加します。その結果、水素イオンが膜を通過するのがより難しくなります。これにより、電極の平衡電位が変化し、pHの読み取りが変化します。
高温でのpH測定には、緑色の膜ガラス「U」を使用したpH電極を使用してください。これらの電極は耐熱性が高いため、より適しています。
- 例: メトローム ユニトロード電極 (図1)

低温でのpH測定にも同様の影響が見られます。低温では、膜がより硬くなり、イオンの輸送が難しくなります。また、電解質溶液中の水素イオンの活性が低温で低下します。これらの影響により、膜の抵抗が増加します。
概して言えば、測定溶液が10 K冷却されると、膜の抵抗は倍増します【1,2】。
低温でのpH測定には、青色の「T」膜ガラスと濃縮された参照電解質を持つ電極が推奨されます。参照電解質には凍結防止剤として作用する溶媒が含まれています。
- 例:メトローム プロトロード電極 (図2.)
温度センサーとpH電極の正しい位置決め
温度センサーはpH電極のガラス膜のすぐ近くに配置してください。そうでない場合、測定液の温度を正しく測定することができません。
さらに、温度とpHが同じ場所で測定されないため、pH補正が不正確になります。
この影響を完全に避けるためには、温度センサーが内蔵されたpH電極を使用してください。この場合、温度センサーは電極内部でガラス膜のすぐ近くに配置されています(図3参照)。

「ロングライフ」参照システムを備えた組み合わせpH電極
市場に出回っているほとんどのpH電極は、Ag/AgCl参照システムを備えた組み合わせ型pH電極です。塩化銀の溶解度積は温度に依存します。
水中の塩化銀の溶解度積は約10-10 mol2/L2と非常に小さいです。しかし、塩化銀は複合体形成の下で非常に容易に溶解します。温度が上昇するとこの効果が促進され、固体と溶解した塩化銀の間の平衡が変化します。したがって、温度が変化すると、参照電極の電位を決定するこの平衡が安定するまで待つ必要があります。
メトロームのpH電極で使用されている「ロングライフ」参照システム(図4)のおかげで、銀、塩化銀(固体)、および塩化銀(溶解)の間の熱力学的平衡が非常に迅速に確立され、参照電極の電位はごく短時間で安定します。

以下の影響を最小限に抑えるために、pH電極の校正は、その後のpH測定で使用する温度と同じ温度で実施する必要があります。
測定溶液の温度
25°Cにおける純水のpH値は7.00です。この場合、水中には同じ数のヒドロニウムイオンと水酸化物イオンが存在します。水のイオン積は温度に依存するため、この平衡は温度が低いほどpHが高くなり、逆に温度が高いとpHは低くなります。これらの平衡変動は、緩衝溶液やよく知られている酸および塩基では確認されていますが、すべての種類のサンプル溶液については確認されていません(例については表2を参照)。
表2. 温度変化がサンプルのpH値にどのように影響するかを示す3つの例 [3]
| 異なる温度で測定された溶液のpH | 0 ℃ | 25 ℃ | 50 ℃ |
|---|---|---|---|
| H2O | 7.47 | 7.00 | 6.63 |
| c = 0.001 mol/L HCl * | 3.00 | 3.00 | 3.00 |
| c = 0.001 mol/L NaOH | 11.94 | 11.00 | 10.26 |
* 酸性物質のpH測定においては、温度の影響は比較的小さいです。この場合、温度が上昇するとpH値が上昇する傾向があります。
最も最新のpHメーターであっても、電極の温度特性の補正は可能ですが、測定される溶液の温度特性までは補正できません。正確なpH測定を行うためには、サンプルを採取した温度でpH値を測定することが重要です。例えば、サンプルが10°Cで採取された場合、pH電極の校正とサンプルの測定も10°Cで行う必要があります。この手順に従うことで、不要な熱平衡の影響を避け、pH電極の応答を速くすることができます。
結論
高品質なメトロームpH電極は、その最適化された構造により、実際の動作が理想的な値からわずかにしか逸脱しません(非対称電位は最大±15 mV)。しかし、ほとんどの物事と同様に、影響を与える要因は1つではありません。
以下のチェックリストは、校正およびpH測定時に正確な測定結果を得るための参考になります。すべての項目に「はい」と答えられるなら、温度変化による影響のほとんどが考慮されています。
| YES / NO | |
|---|---|
| ( ) | 私は、用途に適した膜ガラスの種類を考慮して、適切なpHガラス電極を選択した。 |
| ( ) | 複合pHガラス電極には「ロングライフ」参照システムが装備されている。 |
| ( ) | 温度センサーは、pH電極のガラス膜の近くにセットされている。 OR 校正およびpH測定のために、温度センサー付きの複合pHガラス電極を使用している。 |
| ( ) | pHメーターには温度補償機能が付いている。 |
| ( ) | 校正は、その後pH測定するサンプルと同じ温度で行う。 |
| ( ) | すべての測定対象のサンプル溶液は同じ温度に保たれている。 |
参考文献
[1] Degner, R.; Leibl, S. PH Messen: So Wird’s Gemacht!; Wiley, 1995.
[2] Galster, H. PH-Messung: Grundlagen, Methoden, Anwendungen, Geräte; VCH, 1990.
[3] pH und Temperatur – zwei untrennbare Größen. Wiley Analytical Science. https://analyticalscience.wiley.com/do/10.1002/was.00050234 (accessed 2023-02-09).
 情報共有
情報共有